1.4.1本周全球TOP10创新药研发进展
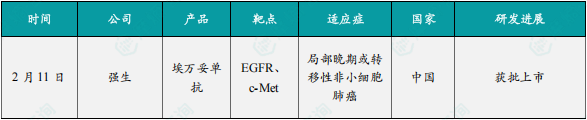
(1)强生制药埃万妥单抗在中国获批上市,针对局部晚期或转移性非小细胞肺癌
2月11日,强生宣布锐珂(埃万妥单抗)的上市申请获得国家药监局批准。埃万妥单抗是全球首款EGFR/c-MET双抗,用于携带EGFR 20号外显子插入突变的非小细胞肺癌患者的一线治疗;。作为全球首款EGFR/c-MET双抗,埃万妥单抗可同时结合EGFR和c-Met的胞外结构,阻断配体与受体结合,促进受体降解,并触发抗体依赖性细胞毒性。2021年5月获FDA加速批准用于铂类化疗进展后的患者;2024年7月,III期PAPILLON研究显示,联合化疗显著改善无进展生存期(PFS),疾病进展或死亡风险降低61%;在PAPILLON研究中,联合治疗组的PFS显著优于单独化疗组,且在奥希替尼耐药的NSCLC患者中也显示出显著的PFS改善,具有很好的疗效。
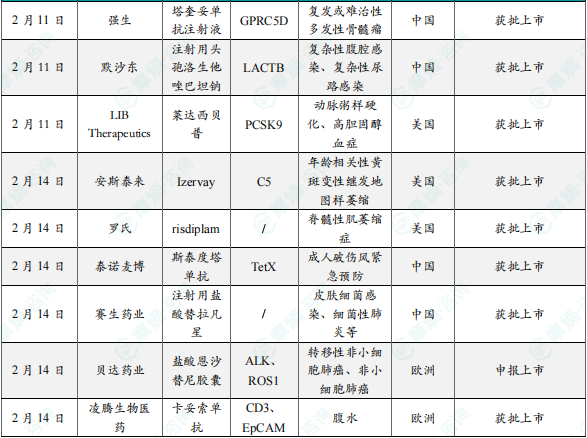
(2)强生制药塔奎妥单抗注射液在中国获批上市,针对复发或难治性多发性骨髓瘤
2月11日,强生宣布塔奎妥单抗注射液的上市申请获得国家药监局批准。该药用于既往接受过至少三线治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38抗体)的复发或难治性多发性骨髓瘤(RRMM)成人患者。作为全球首款靶向CD3×GPRC5D的T细胞衔接双抗,塔奎妥单抗通过重定向T细胞杀伤多发性骨髓瘤细胞。2023年8月获FDA加速批准,基于MonumenTAL-1临床试验结果,该试验显示塔奎妥单抗在既往多线治疗的患者中表现出高缓解率。治疗效果:在MonumenTAL-1研究中,塔奎妥单抗的总缓解率(ORR)超过70%,且应答持久,即使在既往接受过T细胞重定向治疗的患者中,也有65%达到缓解塔奎妥单抗是首个靶向GPRC5D的双特异性抗体,用于复发或难治性多发性骨髓瘤,为患者的用药提供了更多的选择。
(3)默沙东注射用头孢洛生他唑巴坦钠在中国获批上市,可用于治疗复杂感染
2月11日,默沙东抗生素复方药物注射用头孢洛生他唑巴坦钠获得中国国家药监局(NMPA)批准上市,主要用于治疗复杂性腹腔感染(cIAI)、复杂性尿路感染(cUTI)、医院获得性细菌性肺炎(HABP)和呼吸机相关性细菌性肺炎(VABP)。该药物由头孢洛生和他唑巴坦组成。头孢洛生通过抑制革兰氏阴性菌细胞壁合成发挥抗菌作用,而他唑巴坦则抑制耐药菌产生的β-内酰胺酶,防止其对头孢洛生的水解,两者协同作用,增强抗菌效果。在中国,默沙东完成了针对复杂性腹腔感染的III期临床研究(MK-7625A-015),并基于此研究结果获得批准。在中国进行的III期临床研究中,Zerbaxa联合甲硝唑与美罗培南对比治疗复杂性腹腔感染,结果显示,Zerbaxa组的临床治愈率为95.2%,美罗培南组为93.1%,达到非劣效标准。
(4)LIB公司第三代PCSK9抑制剂莱达西贝普在美国获批上市,拟治疗动脉粥样硬化
2月11日,LIB Therapeutics公司宣布其开发的第三代PCSK9抑制剂莱达西贝普(Lerodalcibep)的生物制品许可申请(BLA)已获美国食品药品监督管理局(FDA)受理,用于降低低密度脂蛋白胆固醇(LDL-C),以治疗动脉粥样硬化性心血管疾病(ASCVD)或高风险ASCVD患者。在关键III期试验中,莱达西贝普显示出显著的LDL-C降低效果:在杂合子家族性高胆固醇血症(HeFH)患者中,LDL-C平均降低58.6%。在动脉粥样硬化性心血管疾病(ASCVD)患者中,LDL-C平均降低56.2%-65.9%。超过90%的患者在治疗期间实现了LDL-C降低50%以上,并达到指南推荐的LDL-C目标。此外,莱达西贝普的耐受性良好,注射部位反应轻微,未导致更高的治疗中断率。其每月一次的小剂量皮下注射和室温稳定性设计,显著提高了患者的依从性。
(5)安斯泰来新药Izervay在美国获批上市,用于治疗年龄相关性黄斑变性
2月13日,安斯泰来宣布美国食品药品监督管理局批准了Izervay(avacincaptad pegol)的补充新药申请(sNDA),用于治疗年龄相关性黄斑变性(AMD)继发的地图样萎缩(GA)。GA是一种进展性的晚期AMD形式,会导致视网膜中央区域(黄斑)的萎缩性病变,进而引起不可逆的视力丧失。Izervay是一种补体C5抑制剂,通过结合并抑制补体蛋白C5,阻止其裂解为C5a和C5b,从而减少膜攻击复合物(MAC)的形成,减缓GA病变的进展。III期临床试验试验评估了Izervay在2年内的安全性和有效性,结果显示,每月给药可使病变生长速率每年降低14%。安斯泰来于2023年8月首次获得FDA批准,并于2025年2月获得扩展标签批准,解除了给药时间的限制。此次批准使Izervay成为首个FDA批准的、可在超过12个月的时间内持续使用的GA治疗药物,为医生和患者提供了更大的灵活性。
(6)罗氏新药Evrysdi片剂在美国获批上市,用于治疗脊髓性肌萎缩症
2月14日,罗氏宣布其开发的Evrysdi®(risdiplam)片剂获得美国食品药品监督管理局批准,用于治疗脊髓性肌萎缩症,这种疾病会导致运动神经元存活蛋白(SMN)的缺乏,从而引发肌肉萎缩。Evrysdi是一种SMN2前mRNA剪接修饰剂,通过调节SMN2基因的剪接过程,增加功能性SMN蛋白的产生,从而改善SMA患者的运动功能和生存率。Evrysdi的研发由罗氏与SMA基金会和PTC Therapeutics合作完成。此外,Evrysdi于2017年获得FDA孤儿药资格认证,并在2021年获得英国药理学会的年度药物发现奖。FDA批准Evrysdi片剂的依据是一项生物等效性研究,结果显示5mg片剂(整片吞服或分散于水中)与口服溶液具有相同的药效和安全性。Evrysdi已在全球超过100个国家获批,治疗超过16,000名SMA患者。
(7)泰诺麦博新药斯泰度塔单抗注射液在中国获批上市,用于成人破伤风紧急预防
2月14日,泰诺麦博宣布新药斯泰度塔单抗注射液在中国获批上市,主要用于成人破伤风的紧急预防。该药物通过特异性结合破伤风毒素的AB片段,中和毒素的毒性,起到被动免疫的作用。斯泰度塔单抗是全球首款重组抗破伤风毒素全人源单克隆抗体,具有特异性强、亲和力高、安全性高且不引起免疫排斥反应的优点。该药物于2020年11月首次公示临床试验,2021年在国内获批临床并启动试验。2023年12月,其上市申请获国家药监局(NMPA)受理并纳入优先审评程序。2025年2月13日,斯泰度塔单抗正式获批上市。斯泰度塔单抗在临床试验中显示出良好的安全性和有效性,能够有效中和破伤风毒素,为破伤风的紧急预防提供了新的选择。
(8)赛生药业宣布注射用盐酸替拉凡星在中国获批上市
2月14日,赛生药业宣布新药注射用盐酸替拉凡星在中国获批上市,主要用于治疗由金黄色葡萄球菌敏感分离株引起的医院获得性和呼吸机相关细菌性肺炎(HABP/VABP)。此外,该药物在美国已获批用于治疗复杂性皮肤及软组织感染(cSSTI)。替拉凡星是一种脂糖肽类抗生素,具有双重抗菌机制。替拉凡星最初由Theravance公司研发,最早于2009年获得美国FDA批准。赛生药业于2015年5月与Theravance达成协议,获得在中国大陆、香港、澳门、台湾地区及越南的独家开发和商业化权利。此次在中国的获批基于两项III期国际多中心临床试验(ATTAIN-1和ATTAIN-2)的结果,其中ATTAIN-2试验在中国入组了63例受试者,并顺利通过国家药监局的现场核查。替拉凡星的半衰期更长,每日仅需给药一次,显著提高了患者的依从性和临床应用的便捷性。在微生物学可评价人群中,替拉凡星的治愈率高于万古霉素。
(9)贝达药业新药盐酸恩沙替尼胶囊在欧洲申报上市,针对非小细胞肺癌
2月14日,贝达药业新药盐酸恩沙替尼胶囊在欧洲申报上市,主要用于治疗间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者,是一种新型强效、高选择性的ALK抑制剂。恩沙替尼通过抑制ALK蛋白的活性,阻断其下游信号通路,从而抑制肿瘤细胞的增殖和生长。它是一种口服的酪氨酸激酶抑制剂,能够竞争性结合到ALK的ATP结合位点,从而抑制其激酶活性。恩沙替尼由贝达药业和其控股子公司Xcovery共同开发,具有完全自主知识产权,2024年12月获得美国FDA批准上市。基于国际多中心III期临床研究(eXalt3)的结果,恩沙替尼在治疗ALK阳性NSCLC患者中表现出显著的疗效,其中位无进展生存期(mPFS)显著优于对照药物。恩沙替尼已在中国和美国获批上市,并被纳入医保,显示出良好的市场前景。
(10)凌腾医药卡妥索单抗在欧洲获批上市,针对晚期癌症
2月14日,凌腾医药宣布新药卡妥索单抗在欧洲获批上市,主要用于治疗上皮细胞粘附分子(EpCAM)阳性且不适合进一步全身抗肿瘤治疗的成人患者的恶性腹水。恶性腹水常见于多种晚期癌症,如卵巢癌、胃癌、结直肠癌、乳腺癌、胰腺癌等。卡妥索单抗是一种三功能双特异性单克隆抗体,能够同时靶向:肿瘤细胞上的EpCAM、T细胞上的CD3、免疫辅助细胞上的Fcγ受体。通过激活T细胞和免疫辅助细胞,卡妥索单抗能够增强对肿瘤细胞的杀伤能力,同时减少全身毒性。基于II/III期研究结果,卡妥索单抗在无穿刺生存期(PuFS)上表现出显著优势,是对照组的4倍。在II/III期研究中,卡妥索单抗显著延长了患者的无穿刺生存期(PuFS),减少了穿刺次数,降低了治疗相关痛苦,表现出良好的安全性和耐受性,改善了患者的生活质量。
1.4.2本周全球TOP10积极/失败临床结果
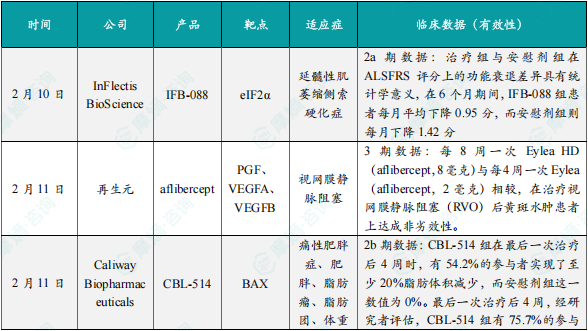
(1)InFlectis小分子疗法临床2a期试验结果积极,针对延髓性肌萎缩侧索硬化症
2月10日,InFlectis BioScience公司宣布临床2a期试验 ——P288ALS TRIAL已顺利完成。该试验围绕公司研发的口服小分子疗法IFB - 088展开,旨在深入探究其针对延髓性肌萎缩侧索硬化症的初步治疗效果与安全性特征,具有重要的临床意义和研究价值。此次试验的核心任务是评估在与已获批的治疗药物 riluzole 联合使用时,每日两次、每次剂量为25毫克的IFB - 088与安慰剂相比,在延髓性肌萎缩侧索硬化症患者群体中的疗效差异和安全性表现。IFB - 088 展现出了良好的安全性和耐受性,在整个试验过程中,未发现任何具有临床意义的不良反应,成功达到了预先设定的主要终点。在意向治疗(ITT)人群(n = 51)中,根据 ALS 功能评分量表(ALSFRS)的专业评估,IFB - 088 组患者表现出相对较低的功能衰退趋势。在严格遵从治疗方案的人群(n = 40)中,治疗组与安慰剂组在ALSFRS评分上的功能衰退差异经统计学分析具有显著意义。在为期6个月的试验周期内,IFB - 088 组患者每月平均功能衰退评分为 0.95 分,而安慰剂组则达到每月1.42分,这一显著的差异不仅在统计学上具有说服力。
(2)再生元宣布QUASAR临床3期试验积极结果
2月11日,再生元制药公司公布了 QUASAR 临床 3 期试验的积极成果。数据分析表明,在针对视网膜静脉阻塞(RVO)后继发性黄斑水肿患者的治疗中,每8周一次给予 Eylea HD(阿柏西普,8 毫克)与每 4 周一次给予 Eylea(阿柏西普,2 毫克)相比,达到了非劣效性标准。在完成初始 5 次每月一次给药的患者群体中,93% 的患者能够维持每 8 周一次的给药方案。结果显示,QUASAR 试验在 36 周时成功达到主要终点,接受每 8 周一次给药的两组 Eylea HD 患者,在视力改善方面均不逊色于接受每 4 周一次 Eylea 治疗的患者。Eylea HD 在分支性视网膜静脉阻塞以及中央性或半视网膜静脉阻塞患者中均展现出稳定一致的疗效。此外,在接受 Eylea HD 治疗 36 周的患者中,初始 3 次每月一次给药后,88% 的患者能够维持每 8 周一次的给药方案;而在完成初始 5 次每月一次给药后,这一比例提升至 93%。
(3)Caliway宣布在研疗法CBL-514的2b期临床结果,奠定三期研究基础
2月11日,Caliway宣布在研疗法CBL-514的第二项2b期临床试圆满结束。CBL - 0205 的 2b 期临床试验为多中心、随机双盲、安慰剂对照研究,共纳入 173 名腹部脂肪堆积达中度(3 级)或重度(4 级)的参与者。他们每三周接受一次腹部皮下注射,最多 4 次,在最后一次治疗后的 4 周和 8 周进行随访。核磁共振成像数据表明,最后一次治疗 4 周后,CBL - 514 组 54.2% 的参与者脂肪体积减少至少 20%,而安慰剂组为 0%(p<0.00001);CBL - 514 组 75.7% 的参与者实现至少 1 级 AFRS 评分改善,安慰剂组仅 27.5%(p<0.00005),且常规抽脂手术通常也只能达到 1 级 AFRS 评分改善。这说明 CBL - 514 能有效减少皮下脂肪,4 周内效果显著。安全性上,CBL - 514 安全性与耐受性良好,与过往研究一致,未出现药物相关严重不良事件或全身性副作用,最常见的是轻至中度注射部位反应。
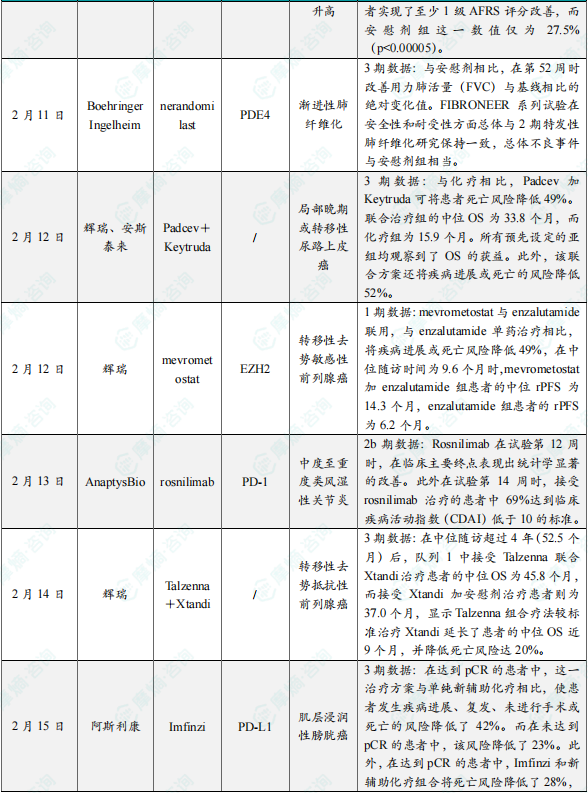
(4)勃林格殷格翰宣布在研疗法nerandomilast 3期临床试验积极结果
2月11日,勃林格殷格翰公司宣布在研疗法nerandomilast,在3期临床试验FIBRONEER-ILD中达到主要终点。Nerandomilast 是一种口服小分子抑制剂,对磷酸二酯酶 4B(PDE4B)具有偏向抑制作用,兼具抗炎症和抗纤维化的双重功效。其临床开发计划涵盖两项 3 期研究,分别是针对特发性肺纤维化(IPF)患者的 FIBRONEER - IPF 试验,以及针对渐进性肺纤维化患者的 FIBRONEER - ILD 试验。勃林格殷格翰公司今日宣布,在研疗法 nerandomilast 在 3 期临床试验 FIBRONEER - ILD 中达到主要终点,与安慰剂相比,在第 52 周时改善了用力肺活量(FVC)与基线相比的绝对变化值,FVC 是衡量肺功能的关键指标之一。基于这些结果,该公司计划向美国 FDA 及全球其他监管机构提交 nerandomilast 治疗渐进性肺纤维化(PPF)的新药申请。这款抑制剂在靶点选择性上优势显著,优先抑制 PDE4B。初步数据显示,FIBRONEER 系列试验在安全性和耐受性方面总体与 2 期特发性肺纤维化研究一致,总体不良事件与安慰剂组相当。
(5)辉瑞/安斯泰来将公布3期临床试验EV-302的长期随访结果
2月12日,辉瑞与安斯泰来公司宣布,将在美国临床肿瘤学会泌尿生殖系统癌症研讨会(ASCO GU)上,公布3期临床试验EV-302的长期随访结果。这项研究评估了抗体偶联药物 Padcev(enfortumab vedotin)与 Keytruda 联用,治疗既往未接受治疗的局部晚期或转移性尿路上皮癌(la/mUC)患者的效果。结果显示,在中位随访时间为 29.1 个月时,这一组合疗法的总生存期(OS)和无进展生存期(PFS)获益持续保持。与化疗相比,Padcev 加 Keytruda 可将患者死亡风险降低 49%(HR=0.51,95% CI:0.43–0.61)。联合治疗组的中位 OS 为 33.8 个月,而化疗组为 15.9 个月。所有预先设定的亚组均观察到了 OS 的获益。此外,该联合方案还将疾病进展或死亡的风险降低 52%(HR=0.48,95% CI:0.41–0.57)。联合治疗组的中位 PFS 为 12.5 个月,而化疗组为 6.3 个月。安全性特征与以往结果一致,未发现新的安全问题。
(6)辉瑞EZH2抑制剂mevrometostat+雄激素受体抑制剂Xtandi联合疗法的1期临床结果积极
2月12日,辉瑞公司公布所研发的 EZH2 抑制剂 mevrometostat,与雄激素受体抑制剂 Xtandi(enzalutamide)联合用于治疗转移性去势抵抗性前列腺癌(mCRPC)患者的 1 期临床试验结果。根据数据表明,相较于 enzalutamide 单药治疗,mevrometostat 与 enzalutamide 联合使用,可使疾病进展或死亡风险降低 49%。在中位随访时间为9.6个月时,mevrometostat加enzalutamide组患者的中位rPFS为14.3个月(7.5个月,不可评估),enzalutamide组患者的rPFS为6.2个月(4.1个月,13.9个月)。Mevrometostat/enzalutamide组合与enzalutamide相比,将疾病进展或死亡风险降低49%(HR=0.51,90% CI,0.28,0.95)。此外,在基线时携带可评估病灶的患者中,mevrometostat/enzalutamide组合组的总缓解率为26.7%,enzalutamide单药组这一数值为15.4%。
(7)AnaptysBio公司宣布在研疗法rosnilimab的2b期临床试验RENOIR结果
2月13日,AnaptysBio公司宣布在研疗法rosnilimab,在治疗中度至重度类风湿性关节炎(RA)患者的2b期临床试验RENOIR中获得积极顶线结果。RENOIR 试验纳入 424 例中度至重度类风湿关节炎(RA)患者,他们在接受常规抗风湿药物(cDMARDs)治疗时,分别使用不同剂量 rosnilimab 或安慰剂。结果显示,第 12 周 rosnilimab 达到主要终点,在 DAS - 28 CRP 评分上与安慰剂有显著差异。第 14 周,69% 接受 rosnilimab 治疗的患者达到 CDAI 疾病活动降低标准,后续随访显示患者维持疾病缓解。整个试验期间,患者平均 CRP 水平降低约 50%,抗炎效果显著。安全性上,rosnilimab 在 2 期临床试验中安全性和耐受性良好,未出现恶性肿瘤、主要心血管不良事件,严重感染未增加,无相关过敏反应,注射部位反应发生率低。
(8)辉瑞公布TALAPRO-2临床3期研究积极结果,显著延长患者总生存期
2月14日,辉瑞公布TALAPRO-2临床3期研究的积极结果。结果显示,中位随访超 4 年(52.5 个月)后,队列 1 中 Talzenna 联合 Xtandi 治疗患者中位 OS 为 45.8 个月 ,Xtandi 加安慰剂组为 37.0 个月,联合疗法使患者中位 OS 延长近 9 个月,死亡风险降低 20%。队列 2 中,HRR 突变型 mCRPC 患者也有显著 OS 改善。中位随访 44.2 个月时,联合治疗组中位 OS 为 45.1 个月,Xtandi 联合安慰剂组为 31.1 个月,联合疗法使患者中位 OS 延长 14 个月,死亡风险降低 38%,且携带与不携带 BRCA 基因突变的患者均有改善。
(9)阿斯利康公布3期临床试验NIAGARA的事后探索性亚组分析结果
2月15日,阿斯利康在美国临床肿瘤学会泌尿生殖系统肿瘤学研讨会(ASCO GU)上,公布了3期临床试验NIAGARA的事后探索性亚组分析结果。在 NIAGARA 试验里,患者先接受四个周期的 Imfinzi 联合新辅助化疗,接着进行根治性膀胱切除术,之后再接受八个周期的 Imfinzi 单药治疗。结局表明,在达到病理完全缓解(pCR)的患者中,相较于单纯新辅助化疗,该治疗方案使患者发生疾病进展、复发、未进行手术或死亡的风险降低了 42%;在未达到 pCR 的患者中,该风险降低了 23%。同时,在达到 pCR 的患者中,Imfinzi 和新辅助化疗组合使死亡风险降低了 28%,在未达到 pCR 的患者中死亡风险降低了 16%。与活性对照组相比,Imfinzi 围手术期方案在意向治疗(ITT)人群中还改善了无转移生存期(MFS)和疾病特异性生存期(DSS)这两个次要终点。该方案让发生远处转移或死亡的风险降低了 33%,因膀胱癌导致的死亡风险降低了 31%。
(10)Corbus发布在研抗体偶联药物CRB-701在美国和英国进行的临床试验数据
2月15日,Corbus Pharmaceuticals发布了在研抗体偶联药物(ADC)CRB-701(SYS6002),在美国和英国进行的首个人体剂量递增临床试验的数据。这项研究招募了转移性尿路上皮癌(mUC)及其他与Nectin-4表达相关的实体瘤患者。初步结果显示,CRB-701在mUC、宫颈癌和头颈部鳞状细胞癌(HNSCC)患者中均展现出临床活性。CRB-701采用酶催化定点抗体偶联技术,能将有丝分裂抑制剂MMAE针对性地导向Nectin-4表达的癌细胞,而其连接子的稳定性有助于将高浓度的MMAE送达肿瘤中,并同时通过减少不良的全身暴露量而将副作用减低。
同期事件:
1. 2025年第7周02.10-02.16国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第7周02.10-02.16国内仿制药/生物类似物申报/审批数据分析
3. 2025年第7周02.10-02.16国内医药大健康行业政策法规汇总
以上内容均来自{摩熵咨询医药行业观察周报(2025.02.10-2025.02.16)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询tyc7111cc太阳成集团(原药融云)数据库(vip.ybspc.cn/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论